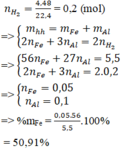hòa tan 12g h2 gồm Al , Ag vào dd H2SO4 loãng , dư . pư kết thúc thu đc 13,44l khí H2 (đktc) . thành phần % khối lượng của Al , Ag trg h2 là bn?

Những câu hỏi liên quan
hòa tan 12g hỗn hợp gồm Al, Ag vào dd H2SO4 loãng dư. Pư kết thúc thu đc 13,44 l khí H2(đktc).Thành phần % khối lượng của Ag trong hỗn hợp là bn?
Hòa tan 12g hỗn hợp gồm Al, Ag vào dung dịch
H
2
SO
4
loãng, dư. Phản ứng kết thúc thu được 13,44 lít khí
H
2
(đktc). Thành phần % khối lượng của Al, Ag trong hỗn hợp lần lượt là A. 70% và 30% B. 90% và 10% C. 10% và 90% D. 30% và 70%
Đọc tiếp
Hòa tan 12g hỗn hợp gồm Al, Ag vào dung dịch H 2 SO 4 loãng, dư. Phản ứng kết thúc thu được 13,44 lít khí H 2 (đktc). Thành phần % khối lượng của Al, Ag trong hỗn hợp lần lượt là
A. 70% và 30%
B. 90% và 10%
C. 10% và 90%
D. 30% và 70%
Đáp án B
Cho Al và Ag phản ứng với H 2 S O 4 loãng, dư chỉ có Al phản ứng.
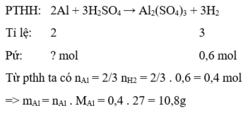
% m A l = 10,8 12 .100 % = 90 % .
% m A g = 100 % - 90 % = 10 %
Đúng 0
Bình luận (0)
Hòa tan 12g hỗn hợp gồm Al, Ag vào dung dịch H2SO4 loãng, dư. Phản ứng kết thúc thu được 13,44 lít khí H2 (đktc). Thành phần % khối lượng của Al, Ag trong hỗn hợp lần lượt là
\(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
_____0,4<-----------------------------------0,6
=> \(\%Al=\dfrac{0,4.27}{12}.100\%=90\%\)
%Ag = 100% - 90% = 10%
Đúng 3
Bình luận (0)
Hòa tan 12g hỗn hợp gồm Al,Ag vào đ H2SO4 loãng,dư/Phản ứng kết thúc thu đc 13,44 lít khí H2 (đktc).Thành phần % khối lượng của Al,Ag trong hỗn hợp là bao nhiêu ?(Giai chi tiết)
Hóa 9
910% và 100%
Sai thôi nha , mk hok ngu Hóa lém ( mặc dù đã hok lp 10 )
Đúng 0
Bình luận (0)
Ag ko t/d với H2SO4 loãng
2AL + 3H2SO4 -> AL2(S04)3 + 3H2
Số mol của H2 = 13,44/22,4 =0,6
Khối lượng của AL = 0,6 x 2/3 = 0,4
% khối lượng của AL trog hỗn hợp là : (10,8/12) x 100% = 90%
% khối lượng của Ag trog hỗn hợp là ; 100% - 90% = 10%
Đúng 0
Bình luận (0)
Xem thêm câu trả lời
Hòa tan 12g hh Al Và Ag vào dd H2SO4 dư thu được 13,44 lít khí (đktc). Tính thành phần % theo khối lượng mỗi hợp chất ban đầu.
Cho 10,2g hh gồm Al và Mg vào dd HCl dư , sau khi PƯ kết thúc thì thu đc 11,2l khí (ở đktc)
a. Hãy tính thành phần % về khối lượng của mỗi kim loại trong hh
b. Dẫn toàn bộ khí H2 thu đc đi qua ống có chứa a gam Fe2O3 đc nung nóng , sau PƯ thì người ta thu đc 60g chất rắn . Hãy tính a
- Đặt \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Mg}=b\left(mol\right)\end{matrix}\right.\Rightarrow27a+24b=10,2\left(1\right)\)
Khí thu được sau p/ứ là khí H2: \(n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
2 3 (mol)
a 3/2 a (mol)
\(Mg+2HCl\rightarrow MgCl_2+H_2\uparrow\)
1 1 (mol)
b b (mol)
Từ hai PTHH trên ta có: \(\dfrac{3}{2}a+b=0,5\left(2\right)\)
\(\left(1\right),\left(2\right)\) ta có hệ: \(\left\{{}\begin{matrix}27a+24b=10,2\\\dfrac{3}{2}a+b=0,5\end{matrix}\right.\)
Giải ra ta có \(\left\{{}\begin{matrix}a=0,2\left(mol\right)\\b=0,2\left(mol\right)\end{matrix}\right.\)
a) \(\%Al=\dfrac{m_{Al}}{m_{hh}}.100\%=\dfrac{0,2.27}{10,2}.100\%\approx52,94\%\)
\(\%Mg=100\%-\%Al=100\%-52,94=47,06\%\)
b)
\(3H_2+Fe_2O_3\rightarrow^{t^0}2Fe+3H_2O\)
3 1 2 (mol)
0,5 1/6 1/3 (mol)
\(m_{Fe}=\dfrac{1}{3}.56=\dfrac{56}{3}\left(g\right)\)
\(m_{Fe_2O_3\left(pứ\right)}=\dfrac{1}{6}.160=\dfrac{80}{3}\left(g\right)\)
\(m_{Fe_2O_3\left(dư\right)}=60-m_{Fe}=60-\dfrac{56}{3}=\dfrac{124}{3}\left(g\right)\)
\(a=\dfrac{124}{3}+\dfrac{80}{3}=68\left(g\right)\)
Đúng 2
Bình luận (0)
cho hỗn hợp x gồm al và ag vào 100 ml dd h2so4 loãng (vừa đủ) . sau khi phản ứng kết thúc thấy thoát ra 2,24 l khí h2 (đktc) và 5,6g một chất rắn không tan
a. tính % về khối lượng của hai kim loại trong hỗn hợp x
b.tính nồng độ mol của h2so4 đã dùng
c.trung hòa toàn bộ lượng h2so4 ở trên bằng v lít dd ba(oh)2 0,2M . tính v
Xem chi tiết
Theo bài ra, ta có: \(m_{Ag}=5,6\left(g\right)\)
PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
a) Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\) \(\Rightarrow n_{Al}=\dfrac{1}{15}\left(mol\right)\) \(\Rightarrow m_{Al}=\dfrac{1}{15}\cdot27=1,8\left(g\right)\)
\(\Rightarrow\%m_{Al}=\dfrac{1,8}{1,8+5,6}\cdot100\%\approx24,32\%\) \(\Rightarrow\%m_{Ag}=75,68\%\)
b) Theo PTHH: \(n_{H_2SO_4}=n_{H_2}=0,1mol\) \(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,1}{0,1}=1\left(M\right)\)
c) PTHH: \(H_2SO_4+Ba\left(OH\right)_2\rightarrow BaSO_4\downarrow+2H_2O\)
Theo PTHH: \(n_{Ba\left(OH\right)_2}=n_{H_2SO_4}=0,1mol\)
\(\Rightarrow V_{ddBa\left(OH\right)_2}=\dfrac{0,1}{0,2}=0,5\left(l\right)=500\left(ml\right)\)
Đúng 1
Bình luận (0)
Hòa tan hoàn toàn 5,5 gam hỗn hợp gồm Al và Fe vào lượng dư dung dịch H 2 SO 4 loãng, thu được 4,48 lít H 2 (đktc). Thành phần phần trăm khối lượng của Fe trong hỗn hợp đầu là
A. 50,91%
B. 76,36%
C. 25,45%
D. 12,73%
Hòa tan hoàn toàn 5,5 gam hỗn hợp gồm Al và Fe vào lượng dư dung dịch H2SO4 loãng, thu được 4,48 lít H2 (đktc). Thành phần phần trăm khối lượng của Fe trong hỗn hợp đầu là:
A. 50,91%
B. 76,36%
C. 25,45%
D. 12,73%
Đáp án A
n H 2 = 0 , 2 ( m o l )
=> mhh= mFe + mAl
Bảo toàn electron:
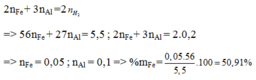
Đúng 0
Bình luận (0)